Cara Kerja Umum Terapi Asam Nukleat
Mekanisme kerja terapi asam nukleat sangat beragam, tergantung pada jenis molekul asam nukleat yang digunakan. Namun, secara umum, mereka memanfaatkan kemampuan asam nukleat untuk berpasangan basa secara spesifik dengan target genetik di dalam sel. Beberapa mekanisme utamanya meliputi:
-
Mengatur Ekspresi Gen:
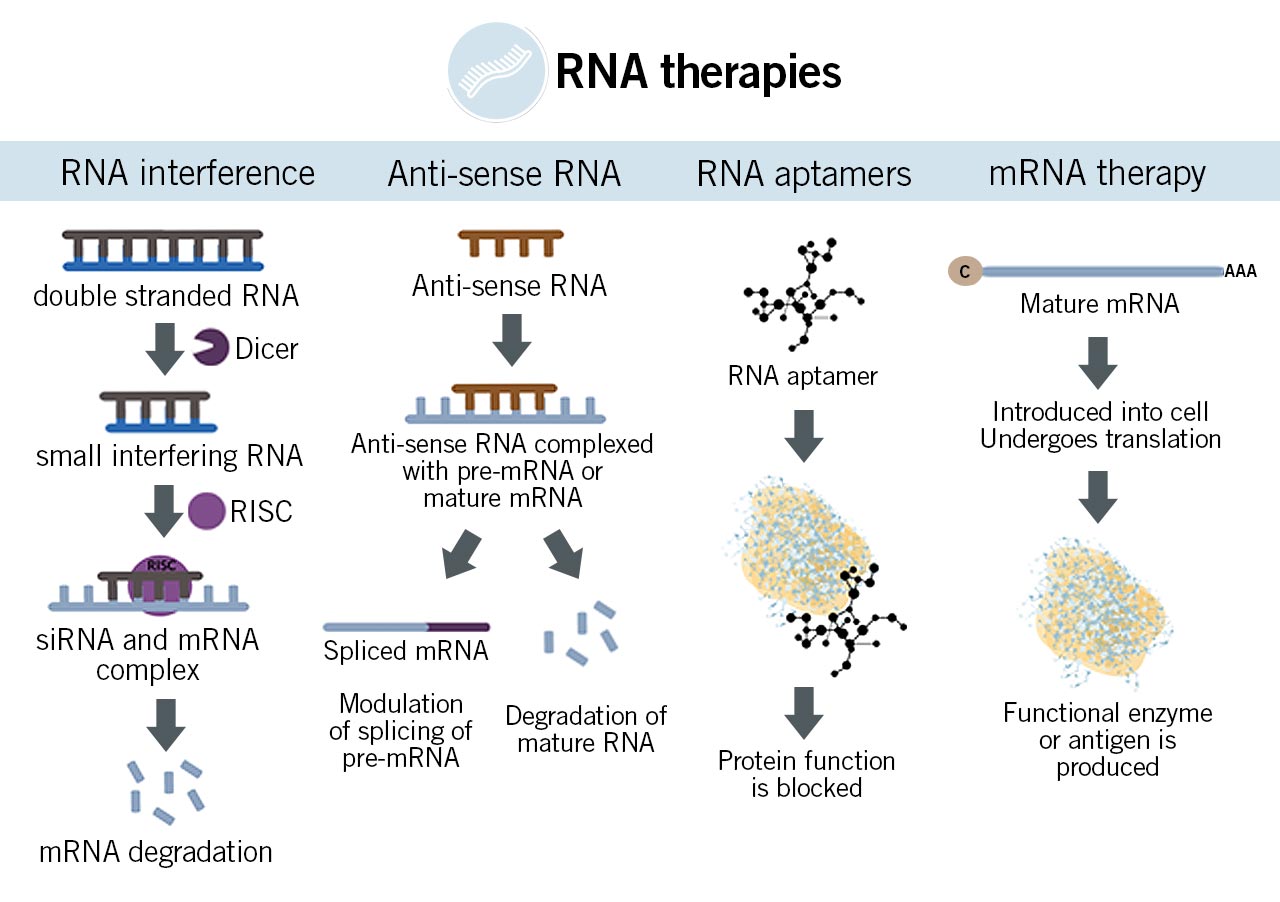
- Menghambat Produksi Protein (Gene Silencing): Ini adalah salah satu mekanisme paling umum. Misalnya, dengan menggunakan siRNA (small interfering RNA) atau ASO (Antisense Oligonucleotides), terapi ini dapat "membungkam" gen tertentu yang menghasilkan protein pemicu penyakit. siRNA bekerja dengan menghancurkan mRNA (messenger RNA) yang membawa instruksi untuk membuat protein, sementara ASO dapat menghambat translasi mRNA atau memengaruhi proses penyambungan (splicing) mRNA.
- Mengaktifkan Produksi Protein: Beberapa terapi, seperti mRNA terapeutik, dapat memberikan instruksi genetik baru kepada sel untuk memproduksi protein yang dibutuhkan tubuh, misalnya pada vaksin mRNA yang menginstruksikan sel untuk membuat protein virus agar sistem kekebalan tubuh dapat mengenalinya.
- Mengoreksi Genetik:
-
Pengeditan Gen (Gene Editing): Teknologi seperti CRISPR-Cas9 menggunakan asam nukleat sebagai panduan (gRNA) untuk secara presisi memotong atau memodifikasi bagian tertentu dari DNA, memungkinkan koreksi mutasi genetik yang menyebabkan penyakit.
-
- Mengikat Molekul Penyakit:
-
Aptamer: Ini adalah molekul asam nukleat (biasanya DNA atau RNA) beruntai tunggal yang dapat melipat menjadi struktur tiga dimensi spesifik dan mengikat target molekul tertentu (misalnya protein) dengan afinitas tinggi, mirip dengan cara antibodi bekerja. Mereka dapat menghambat fungsi molekul target tersebut.
-
Keunggulan dan Tantangan
Keunggulan:
-
Sangat Spesifik: Terapi ini dapat dirancang untuk menargetkan gen atau RNA tertentu dengan presisi tinggi, sehingga mengurangi efek samping yang tidak diinginkan pada sel atau gen lain.
-
Mengatasi Akar Masalah: Mereka bekerja pada tingkat genetik, berpotensi mengatasi akar penyebab penyakit, bukan hanya gejalanya.
-
Potensi untuk Berbagai Penyakit: Memiliki potensi besar untuk mengobati penyakit genetik, kanker, penyakit infeksi, dan gangguan neurodegeneratif yang sebelumnya sulit diobati.
-
Pengembangan Cepat: Desain dan sintesis molekul asam nukleat bisa relatif cepat dibandingkan pengembangan obat tradisional.
Tantangan:
-
Stabilitas: Asam nukleat cenderung tidak stabil di dalam tubuh dan mudah didegradasi oleh enzim.
-
Penghantaran (Delivery): Tantangan terbesar adalah bagaimana cara menghantarkan molekul asam nukleat ke sel dan organ target secara efisien dan aman, karena mereka adalah molekul besar dan bermuatan yang sulit menembus membran sel. Teknologi seperti nanopartikel lipid (LNP) sedang dikembangkan untuk mengatasi ini.
-
Imunogenisitas: Ada potensi respons imun tubuh terhadap molekul asam nukleat asing.
Meskipun memiliki tantangan, bidang terapi asam nukleat telah menunjukkan kemajuan luar biasa dalam dua dekade terakhir, dengan beberapa obat berbasis asam nukleat telah disetujui dan banyak lagi yang sedang dalam uji klinis, menawarkan harapan baru bagi pasien dengan berbagai penyakit.
PENDALAMAN
Revolusi Terapi Asam Nukleat
Terapi Asam Nukleat (NATs) merepresentasikan sebuah terobosan fundamental dalam lanskap pengobatan modern, menawarkan pendekatan yang belum pernah ada sebelumnya untuk mengatasi berbagai penyakit. Kelas obat inovatif ini secara langsung memanfaatkan asam nukleat, baik DNA maupun RNA, atau senyawa yang berkerabat dekat sebagai agen terapeutik.1 Konsep dasar terapi gen, yang menjadi cikal bakal NATs, pertama kali diperkenalkan pada tahun 1990, menandai dimulainya era baru dalam intervensi medis yang menargetkan akar penyebab genetik penyakit.3 Sejak saat itu, penelitian intensif selama dua dekade terakhir telah mengubah pemahaman tentang asam nukleat, dari sekadar molekul penyimpan informasi genetik dan sintesis protein menjadi entitas terapeutik mandiri dengan fungsi yang sangat beragam.1
Dari perspektif pengembangan dan regulasi, NATs menempati posisi yang unik dalam spektrum obat-obatan. Mereka memiliki karakteristik yang menempatkannya di antara molekul kecil konvensional, yang biasanya berinteraksi dengan protein, dan biologis, seperti antibodi, yang juga menargetkan protein.1 Keunikan ini mencerminkan kompleksitas dalam desain, produksi, dan proses persetujuan regulasi yang diperlukan untuk membawa terapi ini ke pasien. Pengakuan akan signifikansi mereka semakin diperkuat dengan klasifikasi NATs sebagai kelas obat utama ketiga, menyusul molekul kecil dan antibodi. Sejak tahun 1998, lebih dari 20 produk NATs telah mendapatkan persetujuan regulasi, dan ratusan uji klinis sedang berlangsung di seluruh dunia, menunjukkan penerimaan yang luas dan pertumbuhan pesat modalitas terapeutik ini dalam industri farmasi.4
Signifikansi dan potensi NATs dalam pengobatan penyakit sangatlah besar. Terapi ini menjanjikan kemampuan untuk mengatasi kebutuhan medis yang belum terpenuhi, termasuk kondisi yang sebelumnya dianggap "tidak dapat diobati".5 NATs beroperasi dengan memodulasi ekspresi gen, menstimulasi sistem kekebalan tubuh, mengedit genom, atau bahkan menyediakan informasi genetik baru, semuanya dengan tujuan mengobati atau mencegah penyakit.5 Dengan spesifisitas yang tinggi, keragaman fungsional, dan profil toksisitas yang terbatas, NATs menjanjikan harapan besar untuk pengobatan berbagai patologi, infeksi, dan bahkan kanker.1 Keberhasilan klinis yang signifikan telah dicapai dalam mengatasi kondisi yang sulit, membuka jalan bagi solusi terapeutik yang lebih efektif dan bertarget.7
Perkembangan NATs menandai pergeseran paradigma yang mendalam dalam farmakologi. Secara tradisional, obat-obatan bekerja dengan berinteraksi pada tingkat protein atau jalur biokimia. Namun, asam nukleat, sebagai "molekul raksasa," secara alami berfungsi sebagai penyimpan dan pengguna informasi genetik, serta terlibat dalam regulasi ekspresi gen.9 Dengan demikian, NATs tidak sekadar menambahkan jenis obat baru, melainkan mengubah cara mendasar kita memahami dan merancang intervensi terapeutik. Mereka memungkinkan manipulasi langsung informasi genetik atau ekspresi gen itu sendiri. Pergeseran ini membuka peluang untuk menargetkan penyakit pada akar penyebab molekulernya, bukan hanya pada gejala atau produk hilir. Ini berarti kemampuan untuk mengobati kondisi yang sebelumnya tidak memiliki pilihan terapi yang efektif, dan bahkan berpotensi menyembuhkan penyakit genetik, mengantarkan era baru dalam kedokteran presisi dan personalisasi.5
Prinsip Fundamental Asam Nukleat dan Interaksinya dalam Biologi Seluler
Memahami prinsip-prinsip dasar asam nukleat adalah krusial untuk mengapresiasi bagaimana Terapi Asam Nukleat (NATs) bekerja. Asam nukleat, DNA (asam deoksiribonukleat) dan RNA (asam ribonukleat), adalah polimer linier sederhana yang merupakan fondasi molekuler kehidupan.1
Struktur Dasar DNA dan RNA
Setiap unit penyusun asam nukleat adalah nukleotida, yang terdiri dari tiga komponen utama: gugus fosfat, basa nitrogen, dan gula pentosa.9 Basa nitrogen terbagi menjadi dua kelompok: purin (adenin (A) dan guanin (G)) dan pirimidin (sitosin (C), timin (T) pada DNA, atau urasil (U) pada RNA).9 Gula pentosa yang membentuk tulang punggung adalah deoksiribosa pada DNA dan ribosa pada RNA.11 Polimerisasi nukleotida terjadi melalui pembentukan ikatan fosfodiester, yang menghubungkan gugus fosfat pada karbon 5' dari satu nukleotida dengan gugus hidroksil pada karbon 3' dari nukleotida berikutnya, membentuk rantai panjang.9 DNA secara khas membentuk struktur heliks ganda, di mana dua rantai polinukleotida berpilin satu sama lain. Stabilitas struktur ini dijaga oleh ikatan hidrogen spesifik antara basa-basa nitrogen: guanin selalu berpasangan dengan sitosin melalui tiga ikatan hidrogen, sementara adenin berpasangan dengan timin (pada DNA) atau urasil (pada RNA) melalui dua ikatan hidrogen.11 Pemahaman mendalam tentang komponen dan ikatan ini sangat penting karena NATs dirancang dengan cermat untuk berinteraksi secara spesifik berdasarkan struktur molekuler ini.
Fungsi Biologis Asam Nukleat
Asam nukleat menjalankan berbagai fungsi vital dalam kehidupan seluler:
-
Penyimpanan Informasi Genetik: DNA memegang peran sentral sebagai repositori utama informasi genetik dalam hampir semua organisme hidup.10 Sekuens nukleotida DNA mengandung pedoman vital yang mengarahkan produksi protein dan molekul RNA yang esensial untuk menjaga integritas struktural dan operasi fungsional sel.10 Informasi genetik ini secara akurat ditransfer dari orang tua ke keturunan selama reproduksi, memastikan pewarisan sifat-sifat herediter.9
-
Replikasi DNA: Proses biologis ini menghasilkan dua molekul DNA yang identik dari satu molekul DNA asli.10 Replikasi yang akurat sangat penting untuk pembelahan sel yang benar dan memastikan bahwa setiap sel anak menerima salinan materi genetik yang persis sama.10
-
Transkripsi: Informasi genetik yang tersimpan dalam DNA disalin menjadi molekul RNA, seperti messenger RNA (mRNA).10 Proses ini adalah langkah pertama dalam ekspresi gen, di mana instruksi genetik diubah menjadi bentuk yang dapat digunakan untuk sintesis protein.
-
Translasi: mRNA yang dihasilkan dari transkripsi membawa instruksi genetik ke ribosom, tempat sintesis protein terjadi.10 Di sini, sekuens kodon pada mRNA diterjemahkan menjadi urutan asam amino spesifik yang membentuk protein fungsional.10
-
Regulasi Ekspresi Gen: Sel memiliki kemampuan yang canggih untuk mengontrol gen mana yang akan diaktifkan dan kapan, serta seberapa banyak produk gen yang akan dihasilkan.10 Regulasi ini memungkinkan sel untuk merespons perubahan lingkungan dan menjaga stabilitas internal dengan memproduksi protein esensial dalam jumlah yang tepat pada waktu yang spesifik.10 Kontrol ekspresi gen terjadi pada berbagai tahapan, termasuk regulasi transkripsional, post-transkripsional, translasional, dan post-translasional, melibatkan faktor transkripsi, mikroRNA, dan modifikasi epigenetik.10
Interaksi Asam Nukleat dengan Molekul Biologis Lainnya
Asam nukleat tidak bekerja secara terisolasi; mereka terlibat dalam interaksi kompleks dengan berbagai molekul lain dalam sistem biologis, termasuk protein dan ligan.13 Memahami interaksi ini sangat penting untuk menjelaskan mekanisme molekuler yang mendasari penyakit dan untuk mengembangkan intervensi terapeutik yang efektif. Misalnya, interaksi DNA-obat menjadi pusat dalam desain agen antikanker dan antimikroba, di mana molekul kecil dirancang untuk menargetkan sekuens DNA spesifik untuk menghambat replikasi DNA atau menginduksi kerusakan DNA pada sel yang sakit. Demikian pula, interaksi DNA-protein memainkan peran penting dalam regulasi gen, perbaikan DNA, dan remodeling kromatin, yang secara langsung memengaruhi proses seluler yang mengatur nasib dan fungsi sel.11
Keberhasilan NATs sangat bergantung pada pemahaman bahwa terapi ini sering kali dirancang untuk meniru atau memodulasi mekanisme dan proses biologis alami yang sudah ada dalam sel. Sebagai contoh, prinsip terapi antisense RNA secara inheren mengadopsi kondisi alamiah, seperti mekanisme pertahanan tanaman terhadap virus atau mekanisme serupa pada nematoda Caenorhabditis elegans.3 Demikian pula, siRNAs bekerja melalui kaskade enzimatik alami yang dikenal sebagai RNA interferensi (RNAi).14 Pendekatan ini, yang memanfaatkan "bahasa molekuler" sel itu sendiri, berpotensi mengurangi efek samping yang merugikan karena memanfaatkan mekanisme regulasi sel.3 Ini juga menjelaskan mengapa NATs secara umum memiliki spesifisitas tinggi, keragaman fungsional, dan toksisitas terbatas.1 Pemahaman mendalam tentang biologi seluler adalah prasyarat mutlak untuk desain NATs yang efektif dan aman, karena mereka bekerja dengan mengintegrasikan diri ke dalam jaringan regulasi molekuler yang kompleks.
Mekanisme Kerja Terapi Asam Nukleat
Mekanisme kerja Terapi Asam Nukleat (NATs) berakar pada kemampuan asam nukleat untuk mengenali dan berinteraksi secara spesifik dengan sekuens genetik target di dalam sel.
Dasar Pengenalan Spesifik Sekuens (Watson-Crick Base Pairing)
Prinsip fundamental yang mendasari sebagian besar mekanisme kerja NATs adalah pengenalan sekuens-spesifik asam nukleat endogen melalui pasangan basa Watson-Crick.1 Ini berarti bahwa molekul NATs dirancang untuk memiliki sekuens basa yang komplementer dengan sekuens DNA atau RNA target di dalam sel. Ketika sekuens komplementer ini bertemu, mereka membentuk ikatan hidrogen yang stabil, menciptakan dupleks asam nukleat. Kemampuan ini memungkinkan NATs untuk menargetkan gen atau mRNA tertentu dengan presisi yang luar biasa, membentuk hibrida yang sangat spesifik dan selektif. Tingkat spesifisitas ini adalah kunci utama yang membedakan NATs dari banyak modalitas obat konvensional, yang seringkali memiliki target yang lebih luas dan potensi efek samping yang lebih besar.
Modulasi Ekspresi Gen (Inhibisi dan Induksi Protein)
Setelah pengenalan sekuens-spesifik terjadi, NATs dapat memodulasi ekspresi gen melalui dua mekanisme utama:
-
Inhibisi Ekspresi DNA atau RNA (Gene Silencing/Protein Knockdown): Dasar fundamental penggunaan asam nukleat dalam terapi, kecuali terapi gen, adalah inhibisi ekspresi DNA atau RNA.1 Dengan cara ini, NATs dapat secara selektif menghentikan atau mengurangi produksi protein abnormal yang terkait dengan suatu penyakit, sambil membiarkan protein lain yang tidak terkait tetap tidak terpengaruh.1 Pendekatan ini dikenal sebagai gene silencing atau protein knockdown. Misalnya, beberapa terapi berbasis RNA, seperti RNA interferensi (RNAi) dan oligonukleotida antisens (ASOs), secara spesifik dirancang untuk mengurangi atau menghilangkan produksi protein yang tidak diinginkan yang berkontribusi pada patologi penyakit.15
-
Induksi Produksi Protein (Gene Expression): Sebaliknya, beberapa jenis NATs, seperti produk mRNA terapeutik, dirancang untuk memicu sintesis protein terapeutik baru.6 Ini dapat mencakup produksi protein yang hilang atau defektif dalam tubuh pasien, atau sebagai antigen untuk memicu respons imun protektif, seperti yang terlihat pada vaksin berbasis mRNA.6
Keunggulan utama NATs terletak pada tingkat presisi molekulernya yang luar biasa. Kemampuan untuk menargetkan sekuens genetik spesifik dengan komplementaritas pasangan basa memungkinkan intervensi yang sangat selektif pada tingkat transkripsi atau translasi. Ini membedakan mereka dari banyak obat tradisional yang mungkin memiliki target yang lebih luas atau mekanisme yang kurang spesifik. Presisi ini secara langsung berkorelasi dengan profil keamanan yang lebih baik dan pengurangan efek samping yang tidak diinginkan.6 Kemampuan untuk menargetkan penyebab penyakit pada tingkat molekuler fundamental adalah kekuatan pendorong di balik revolusi NATs, memungkinkan mereka untuk mengatasi cacat genetik atau disregulasi ekspresi gen yang tidak dapat dijangkau oleh obat konvensional.
Jenis-Jenis Utama Terapi Asam Nukleat
Bidang Terapi Asam Nukleat (NATs) sangat beragam, mencakup beberapa modalitas berbeda yang masing-masing memanfaatkan prinsip asam nukleat dengan cara unik untuk mencapai efek terapeutik. Berikut adalah beberapa jenis utama NATs yang telah menunjukkan potensi besar dalam kedokteran modern:
Oligonukleotida Antisens (ASOs)
ASOs adalah sekuens asam nukleat untai tunggal dan pendek, biasanya berukuran 8-50 pasangan basa, yang dirancang untuk berikatan secara spesifik dengan mRNA target melalui pasangan basa Watson-Crick.1 Setelah berikatan, kompleks ASO-mRNA dapat didegradasi oleh enzim RNase H seluler endogen, atau ASO dapat menyebabkan blokade fungsional mRNA melalui halangan sterik, sehingga mencegah translasi protein yang tidak diinginkan.1
Terdapat dua kategori utama ASOs berdasarkan mekanisme kerjanya:
-
ASOs Aktif Enzim (Enzyme-active ASOs): Umumnya berbasis DNA, ASOs ini mengandalkan mekanisme yang bergantung pada RNase H untuk mengurangi jumlah mRNA target. Dupleks RNA-DNA yang terbentuk berfungsi sebagai substrat bagi enzim RNase H, yang kemudian membelah mRNA target.14
-
ASOs Pengubah Splicing (Splice-switching ASOs atau Enzyme-inactive ASOs): ASOs ini memiliki tulang punggung yang dimodifikasi sehingga tidak dikenali oleh mesin enzimatik seperti RNase H. Sebaliknya, mereka menutupi sekuens oligonukleotida spesifik pada pre-mRNA, sehingga mengubah keputusan splicing, reading frame, dan langkah kunci lainnya dalam translasi. Pendekatan ini dapat mengembalikan fungsi gen yang cacat atau menghambat nonsense-mediated decay, menawarkan mekanisme yang melampaui degradasi RNA target kanonik.14
Beberapa ASOs telah disetujui untuk penggunaan klinis, menunjukkan potensi terapeutik mereka. Fomivirsen (VITRAVENE) adalah ASO pertama yang disetujui oleh FDA/EMA pada tahun 1998 untuk pengobatan retinitis sitomegalovirus (CMV), bekerja dengan menargetkan fragmen IE2 mRNA CMV yang esensial untuk replikasi virus.1 Contoh-contoh lain yang disetujui meliputi:
-
Mipomersen (KYNAMRO), disetujui pada tahun 2013 untuk hiperkolesterolemia familial homozigot (HoFH), bekerja melalui mekanisme RNase H.1
-
Nusinersen (SPINRAZA), disetujui pada tahun 2016 untuk atrofi otot spinal (SMA), bekerja melalui mekanisme exon inclusion.7
-
Beberapa ASOs telah disetujui untuk Duchenne Muscular Dystrophy (DMD) yang bekerja melalui exon exclusion, termasuk Eteplirsen (EXONDYS 51) (2016), Golodirsen (VYONDYS 53) (2019), Viltolarsen (VILTEPSO) (2020), dan Casimersen (AMONDYS 45) (2021).14
-
Inotersen (TEGSEDI) (2018) dan Eplontersen (WAINUA) (2023) disetujui untuk amiloidosis transthyretin herediter (hATTR) melalui mekanisme RNase H.14
-
Volanesorsen (WAYLIVRA) (2019) disetujui untuk sindrom kilomikronemia familial (FCS).14
RNA Interferensi Kecil (siRNAs)
siRNAs adalah sekuens RNA untai ganda pendek, sintetik, yang beroperasi melalui kaskade enzimatik alami yang dikenal sebagai RNA interferensi (RNAi).14 Proses ini dimulai ketika enzim Dicer memotong RNA untai ganda yang lebih panjang menjadi siRNA. siRNA kemudian dimasukkan ke dalam kompleks multiprotein yang disebut RISC (RNA-induced silencing complex), yang di dalamnya terdapat untai antisense siRNA yang dipertahankan. Untai antisense ini kemudian memandu RISC untuk berhibridisasi dengan mRNA target yang komplementer. Ago2, komponen katalitik paling krusial dari RISC, bertanggung jawab untuk pembelahan mRNA target, yang pada akhirnya mengarah pada "penonaktifan" (knockdown) protein yang dikodekan oleh mRNA tersebut.14
Beberapa siRNAs telah mencapai persetujuan regulasi, menunjukkan efektivitas mereka:
-
Patisiran (Onpattro) disetujui pada tahun 2018 untuk amiloidosis transthyretin herediter (hATTR).14
-
Givosiran (GIVLAARI), disetujui pada tahun 2019 untuk porfiria hepatik akut, merupakan satu-satunya obat yang tersedia untuk penyakit ini.7
-
Lumasiran (OXLUMO) disetujui pada tahun 2020 untuk hiperoksaluria primer tipe 1.7
-
Inclisiran (LEQVIO) disetujui pada tahun 2020 (EMA) dan 2021 (FDA) untuk hiperkolesterolemia familial heterozigot (HeFH) atau penyakit kardiovaskular aterosklerotik klinis (ASCVD).7
-
Vutrisiran (AMVUTTRA) disetujui pada tahun 2022 untuk hATTR.14
Aptamer
Aptamer adalah struktur DNA atau RNA tiga dimensi yang dipilih dari kumpulan sekuens yang lebih besar karena kemampuannya untuk berikatan secara spesifik dengan target tertentu, baik itu molekul kecil maupun protein.14 Meskipun memiliki afinitas tinggi terhadap targetnya seperti antibodi, aptamer menawarkan beberapa keunggulan signifikan, termasuk kemudahan skrining dan sintesis, ukuran yang lebih kecil, serta peningkatan permeabilitas dan stabilitas.1
Contoh aptamer yang disetujui atau dalam pengembangan meliputi:
-
Pegaptanib (MACUGEN), aptamer RNA pertama yang disetujui pada tahun 2004 untuk neovascular age-related macular degeneration (AMD), bekerja dengan mengikat protein.7
-
Avacincaptad pegol (IZERVAY), disetujui pada tahun 2023 untuk Geographic Atrophy, menargetkan protein komplemen C5.14
-
Aptamer nukleolin (AS1411) telah menunjukkan kemampuan untuk masuk ke berbagai jenis sel kanker dan menargetkan nukleolin.14
-
Aptamer A10, yang dirancang untuk menargetkan antigen spesifik prostat (PSMA), telah dikonjugasikan dengan siRNA untuk pengiriman spesifik jaringan ke sel kanker prostat.14
CpG Deoksiribonukleotida
CpG deoksiribonukleotida adalah DNA untai tunggal pendek yang memicu respons imunostimulatori.14 Mereka mengaktifkan sel dendritik dan sel B dengan berinteraksi dengan reseptor Toll-like 9, yang mengarah pada kaskade pro-inflamasi.14 Properti ini memungkinkan oligodeoksiribonukleotida CpG digunakan sebagai ajuvan untuk memperkuat respons imun dalam konteks penyakit tertentu. Contoh yang disetujui adalah CpG 1018, yang merupakan bagian dari vaksin Hepatitis B HEPLISAV-B, disetujui pada tahun 2017 sebagai ajuvan untuk vaksin tersebut.14
Terapi Gen
Terapi gen adalah modalitas NATs yang bertujuan untuk mengoreksi gen-gen yang cacat yang bertanggung jawab terhadap suatu penyakit.3 Pendekatan ini melibatkan penggantian gen yang rusak, penambahan gen normal ke dalam sel yang tidak normal, atau modifikasi regulasi pengaktifan gen tertentu.3 Pengiriman gen dapat dilakukan menggunakan metode transfeksi viral (menggunakan vektor virus seperti Adenovirus, Retrovirus, atau Adeno-associated virus/AAV) atau non-viral (seperti liposom, kalsium fosfat, atau mikroinjeksi).2 Terapi gen memiliki potensi besar untuk mengobati penyakit genetik resesif seperti cystic fibrosis, hemofilia, muscular dystrophy, dan sickle cell anemia, serta penyakit yang didapat seperti kanker dan infeksi virus tertentu.17
mRNA Terapeutik
mRNA terapeutik melibatkan pengenalan molekul mRNA ke dalam sel untuk memicu produksi protein terapeutik baru.15 Modalitas ini telah mendapatkan perhatian besar, terutama setelah keberhasilan vaksin COVID-19 berbasis mRNA (Moderna dan Pfizer-BioNTech).6 Selain vaksin, mRNA terapeutik juga dieksplorasi untuk aplikasi seperti penggantian protein, terapi kanker, dan pengobatan penyakit menular lainnya.16
CRISPR-Cas9
CRISPR-Cas9 adalah teknologi pengeditan gen yang revolusioner, sering disebut sebagai "gunting genom," yang memungkinkan modifikasi DNA target dengan akurasi tinggi.12 Sistem ini menggunakan protein Cas (misalnya Cas9) yang dipandu oleh RNA panduan untuk memotong DNA pada area target, memungkinkan penghapusan, penambahan, atau penggantian gen secara akurat.20 Teknologi ini telah menunjukkan hasil yang luar biasa dalam uji klinis dan aplikasi laboratorium.20
Aplikasi CRISPR-Cas9 sangat luas, termasuk:
-
Penyakit Sel Sabit dan Beta-talasemia: Casgevy adalah terapi berbasis CRISPR/Cas9 pertama yang disetujui FDA untuk penyakit sel sabit dan beta-talasemia dependen-transfusi, di mana sel induk hematopoietik pasien diedit untuk meningkatkan produksi hemoglobin janin.21
-
Kanker dan Penyakit Autoimun: Pengembangan terapi sel T CAR (Chimeric Antigen Receptor) alogenik yang diedit gen CRISPR/Cas9 (misalnya CTX112, CTX131) untuk mengobati keganasan dan penyakit autoimun.22
-
Penyakit Kardiovaskular: Terapi pengeditan gen in vivo menggunakan pengiriman nanopartikel lipid (LNP) dari mRNA Cas9 dan gRNA ke hati untuk mengurangi ekspresi protein terkait penyakit jantung.22
-
Penyakit Langka dan Umum Lainnya: Penelitian dan pengembangan sedang berlangsung untuk Duchenne Muscular Dystrophy (DMD), Myotonic Dystrophy Tipe 1 (DM1), Diabetes Mellitus Tipe 1, dan Cystic Fibrosis, serta berbagai penyakit langka dan umum lainnya.22
Tantangan dan Prospek Masa Depan
Meskipun Terapi Asam Nukleat (NATs) telah menunjukkan potensi transformatif yang luar biasa dalam kedokteran, pengembangan dan implementasi luasnya masih dihadapkan pada beberapa tantangan signifikan. Namun, upaya berkelanjutan dalam penelitian dan pengembangan terus membuka prospek masa depan yang cerah bagi modalitas terapeutik ini.
Tantangan Utama
-
Pengiriman Bertarget (Targeted Delivery): Salah satu hambatan terbesar adalah pengiriman molekul asam nukleat ke sel dan jaringan target secara efisien dan spesifik.1 Asam nukleat memiliki sifat polar dan bermuatan negatif, yang menyebabkan penetrasi seluler yang buruk dibandingkan dengan obat molekul kecil konvensional.1 Selain itu, mereka rentan terhadap degradasi oleh enzim nuklease dalam tubuh.17
-
Stabilitas dan Persyaratan Penyimpanan: Banyak NATs, terutama yang berbasis RNA, memerlukan kondisi penyimpanan dingin yang ketat untuk menjaga stabilitasnya, yang dapat menjadi tantangan logistik untuk produksi massal dan distribusi global.6
-
Toksisitas dan Efek Samping di Luar Target (Off-Target Effects): Meskipun NATs dikenal karena spesifisitasnya, risiko efek di luar target tetap ada.7 Interaksi yang tidak diinginkan dengan sekuens asam nukleat yang serupa tetapi bukan target utama dapat menyebabkan hasil yang membingungkan atau toksisitas yang tidak diinginkan.7
-
Produksi Massal dan Biaya: Produksi NATs dalam skala besar dengan biaya rendah masih menjadi tantangan.1 Proses sintesis dan pemurnian yang kompleks dapat membuat terapi ini sangat mahal, membatasi aksesibilitasnya.
-
Imunogenisitas: Beberapa sistem pengiriman, terutama vektor virus, dapat memicu respons imun pada pasien, yang dapat mengurangi efektivitas terapi atau menyebabkan efek samping.6
-
Translasi dari Model ke Manusia: Terkadang, keberhasilan yang diamati dalam model hewan tidak selalu diterjemahkan secara efektif ke dalam uji klinis pada manusia dalam hal efikasi, stabilitas metabolik, dan keamanan.7
Strategi untuk Mengatasi Tantangan
Untuk mengatasi tantangan-tantangan ini, berbagai strategi inovatif sedang dikembangkan:
-
Modifikasi Kimia: Modifikasi kimia pada tulang punggung dan komponen ribosa nukleotida telah secara signifikan meningkatkan stabilitas, kekuatan ikatan, dan spesifisitas NATs terhadap asam nukleat target.1 Contohnya termasuk modifikasi phosphorothioate pada ASOs 1 dan konjugasi GalNAc yang secara efisien mengirimkan oligonukleotida ke hepatosit di hati.7
-
Sistem Pengiriman Inovatif: Pengembangan sistem pengiriman obat (SPO) yang efisien sangat penting untuk memungkinkan pengiriman obat yang ditargetkan ke jaringan yang sakit dengan efisiensi tinggi, sambil meminimalkan efek samping.23 Ini termasuk:
-
-
Nanopartikel Lipid (LNPs): Telah terbukti sangat efektif, terutama dalam pengiriman vaksin mRNA (misalnya vaksin COVID-19 Pfizer-BioNTech) dan terapi pengeditan gen CRISPR/Cas9.6
-
Vektor Viral: Virus yang dimodifikasi (misalnya Adenovirus, Retrovirus, AAV) digunakan sebagai "kendaraan" untuk mentransfer gen target ke dalam sel.6
-
Metode Non-Viral: Termasuk liposom dan lipid kationik yang membentuk kompleks dengan asam nukleat untuk memfasilitasi masuknya ke dalam sel, serta mikroinjeksi.17
-
-
Kolaborasi Interdisipliner: Kemajuan dalam ilmu material, nanoteknologi, rekayasa seluler, dan teknologi rekombinasi genetik telah memperluas peluang dalam mengembangkan SPO.23 Kolaborasi erat antara akademisi dan industri diperlukan untuk meningkatkan penargetan jaringan yang presisi, mengatasi ketidakstabilan, dan mengembangkan metode pengiriman yang lebih baik.6
Prospek Masa Depan
Meskipun tantangan masih ada, prospek masa depan untuk NATs sangat cerah. Kelas obat ini terus berkembang pesat, didorong oleh pemahaman yang lebih baik tentang dasar molekuler berbagai penyakit dan kemajuan teknologi yang mendukung desain, sintesis, dan pengiriman asam nukleat yang efektif.6
NATs memiliki potensi untuk:
-
Mengobati Penyakit yang Sebelumnya "Tidak Dapat Diobati": Mereka dapat menyediakan perawatan baru untuk berbagai kondisi kompleks di mana pilihan saat ini terbatas pada pengelolaan gejala daripada penyembuhan, seperti penyakit Crohn dan Alzheimer.6
-
Pengembangan Vaksin yang Efisien Waktu: Vaksin mRNA dapat dikembangkan dengan cepat menggunakan sekuens genom patogen baru, memungkinkan adaptasi cepat terhadap varian yang muncul.6
-
Kedokteran Presisi dan Personalisasi: Kemampuan untuk menargetkan penyebab penyakit pada tingkat molekuler fundamental memungkinkan pengembangan obat-obatan yang lebih disesuaikan dan berhasil, mengantarkan era baru dalam kedokteran presisi.16
-
Membuka Organ dan Penyakit Baru: Inovasi signifikan terus membuka organ dan penyakit baru untuk aplikasi NATs, menawarkan harapan bagi pasien dengan penyakit yang tidak dapat disembuhkan.4
Dengan semakin banyaknya persetujuan regulasi dan keberhasilan klinis yang signifikan, NATs, termasuk ASOs, siRNA, mRNA, dan CRISPR-Cas, telah menjadi kelas obat yang kuat untuk berbagai penyakit.4 Kemajuan dalam strategi kimia untuk memodifikasi asam nukleat dan meningkatkan pengirimannya menunjukkan bahwa masa depan pengembangan terapi asam nukleat belum pernah secerah ini.7
Kesimpulan
Terapi Asam Nukleat (NATs) telah muncul sebagai pilar fundamental dalam ilmu biomedis kontemporer, merepresentasikan pergeseran paradigma yang signifikan dalam pendekatan pengobatan penyakit. Berawal dari konsep terapi gen pada tahun 1990, NATs telah berkembang menjadi kelas obat utama ketiga, sejajar dengan molekul kecil dan biologis, dengan lebih dari 20 produk yang disetujui dan ratusan uji klinis yang sedang berlangsung.
Kekuatan utama NATs terletak pada kemampuannya untuk secara langsung memanipulasi informasi genetik dan ekspresi gen pada tingkat molekuler. Dengan memanfaatkan prinsip pasangan basa Watson-Crick yang sangat spesifik, NATs dapat secara presisi menghambat produksi protein abnormal penyebab penyakit (melalui modalitas seperti ASOs dan siRNAs) atau menginduksi sintesis protein terapeutik baru (melalui mRNA terapeutik). Selain itu, teknologi pengeditan gen seperti CRISPR-Cas9 menawarkan kemampuan untuk secara permanen mengoreksi cacat genetik, membuka jalan bagi pengobatan kuratif untuk penyakit yang sebelumnya tidak dapat disembuhkan.
Meskipun NATs menawarkan spesifisitas tinggi, keragaman fungsional, dan profil toksisitas yang terbatas, tantangan signifikan masih ada, terutama dalam hal pengiriman bertarget ke sel dan jaringan spesifik, stabilitas molekul, produksi massal yang hemat biaya, dan potensi efek di luar target. Namun, kemajuan pesat dalam modifikasi kimia asam nukleat dan pengembangan sistem pengiriman inovatif, seperti nanopartikel lipid dan vektor viral, secara progresif mengatasi hambatan-hambatan ini.
Secara keseluruhan, NATs menjanjikan era baru dalam kedokteran presisi dan personalisasi. Dengan terus berkembangnya pemahaman tentang dasar molekuler penyakit dan inovasi teknologi yang tak henti, terapi berbasis asam nukleat siap untuk merevolusi cara kita mencegah, mengobati, dan bahkan menyembuhkan berbagai kondisi kesehatan, membawa harapan baru bagi pasien di seluruh dunia.
Daftar Pustaka :
- Therapeutic nucleic acids: current clinical status - PMC, diakses Mei 29, 2025, Lihat
- Therapeutic Nucleic Acids - Creative Biolabs, diakses Mei 29, 2025, Lihat
- RNA Therapeutic, Pendekatan Baru Dalam Terapi Gen - UI Scholars Hub, diakses Mei 29, 2025, Lihat
- Nucleic Acid Therapeutics: Successes, Milestones, and Upcoming Innovation - PMC, diakses Mei 29, 2025, Lihat
- Nucleic Acid Therapeutics | Harvard University, diakses Mei 29, 2025, Lihat
- Nucleic Acid Technologies RTA summary - GOV.UK, diakses Mei 29, 2025, Lihat
- Challenges and Opportunities for Nucleic Acid Therapeutics - PMC - PubMed Central, diakses Mei 29, 2025, Lihat
- The Progress and Evolving Trends in Nucleic-Acid-Based Therapies - PMC, diakses Mei 29, 2025, Lihat
- Makalah Asam Nukleat | PDF | Kesehatan Holistik | Sains & Matematika - Scribd, diakses Mei 29, 2025, Lihat
- Nucleic Acids in Cell Biology | Key Functions Explained - BOC Sciences, diakses Mei 29, 2025, Lihat
- Principles of Nucleic Acid Structure - ResearchGate, diakses Mei 29, 2025, Lihat
- Fungsi Asam Nukleat: Peran Vital dalam Kehidupan Sel - Feeds Liputan6.com, diakses Mei 29, 2025, Lihat
- Laboratorium Biokimia – FK - Universitas Muhammadiyah Palangkaraya, diakses Mei 29, 2025, Lihat
- Nucleic Acid Conjugates: Unlocking Therapeutic Potential | ACS Bio ..., diakses Mei 29, 2025, Lihat
- Overview and Outlook for RNA-Based Therapies - Avalere Health Advisory, diakses Mei 29, 2025, Lihat
- Nanomedicine: Partikel Kecil, Dampak Besar pada Pelayanan Kesehatan - Editverse, diakses Mei 29, 2025, Lihat
- Metode Transfer Asam Nukleat sebagai Dasar Terapi Gen - Neliti, diakses Mei 29, 2025, Lihat
- Naskah Review TERAPI GEN: DARI BIOTEKNOLOGI UNTUK KESEHATAN - E-Journal UIN Jakarta, diakses Mei 29, 2025, Lihat
- Advancing mRNA Therapeutics: The Role and Future of Nanoparticle Delivery Systems | Molecular Pharmaceutics - ACS Publications, diakses Mei 29, 2025, Lihat
- The power couple: CRISPR and oligonucleotides - Cytiva, diakses Mei 29, 2025, Lihat
- FDA Approves First Gene Therapies to Treat Patients with Sickle Cell Disease, diakses Mei 29, 2025, Lihat
- Pipeline - CRISPR Therapeutics, diakses Mei 29, 2025, Lihat
- Abstrak Mesenchymal Stem Cells (MSCs) atau sel punca mesenkim merupakan sel punca dewasa yang bersifat multipoten unik yang bera - Jurnal Universitas Padjadjaran, diakses Mei 29, 2025, Lihat